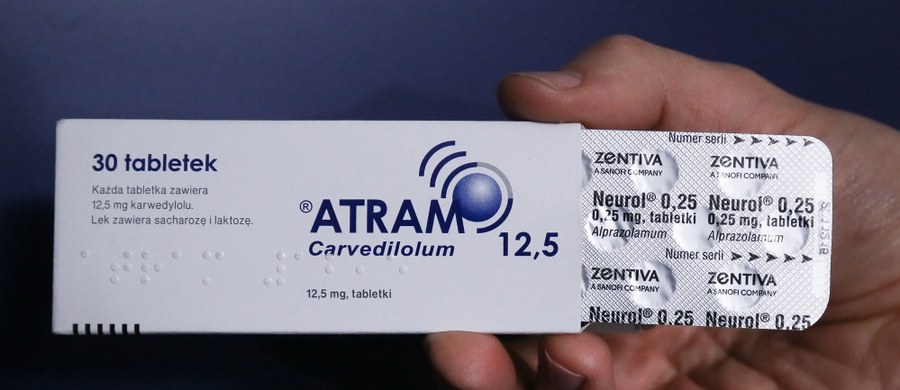
Pacjenci są proszeni o zwrot do aptek trzech serii leku kardiologicznego Atram - poinformował rzecznik Głównego Inspektoratu Farmaceutycznego Paweł Trzciński. Znaleziono dowody, że substancja ta została pomieszana z innym lekiem. GIF obecnie nie wie, ilu pacjentów może dotyczyć sprawa, ani od jak dawna wycofane serie były na rynku.
Chodzi o serie 2561215 i 2510216 (w obu przypadkach chodzi o tabletki Atram 12,5 mg) oraz serię 2010216 (tabletki Atram 6,25 mg). Daty ważności leków to listopad 2017 r. (seria 2561215) i styczeń 2018 r. (pozostałe dwie serie). Decyzję podjęto w związku z zagrożeniem zdrowia publicznego, wynikającym z pomieszania produktów leczniczych Neurol (lek psychotropowy) i Atram (lek kardiologiczny).
Obie substancje już wcześniej zostały wstrzymane w obrocie - od połowy sierpnia nie można było ich kupić. Podejrzewano, że produkty zostały pomieszane. Wykryła to kontrola GIF w jednej z hurtowni. Informacja ta została przekazana do Czech, gdzie lek jest produkowany. Czeski urząd uznał, że zagrożenie jest na tyle poważne, że rozesłał ostrzeżenie (tzw. rapid alert) do pozostałych krajów europejskich w związku z podejrzeniem wystąpienia niebezpiecznych dla zdrowia konsekwencji.
GIF zdecydował także o wycofaniu z obrotu pojedynczych serii czterech leków wytwarzanych przez czeską firmę Zentiva, producenta Atramu. Decyzja GIF dotyczy leków: Simvacard 10 (10 mg tabletki powlekane, nr serii: 3010116, data ważności: grudzień 2018), Endiex (200 mg, kapsułki twarde, nr serii: 2020116, data ważności: grudzień 2017), Zoxon 2 (2 mg, tabletki, nr serii: 3510216, data ważności: styczeń 2019) oraz Chlorprothixen Zentiva (50 mg, tabletki powlekane, nr serii: 3600216, data ważności: styczeń 2019). W decyzji napisano, że we wtorek GIF otrzymał ostrzeżenie (tzw. rapid alert) od swojego odpowiednika w Czechach w sprawie wycofania wspomnianych serii leków. "Decyzja została podjęta w związku z istniejącym ryzykiem pomieszania ww. produktów leczniczych" - napisano w uzasadnieniu.
Z niepotwierdzonych informacji wynika, że jest duże prawdopodobieństwo, że to był pewnego rodzaju sabotaż dokonany przez pracownika, który został z firmy zwolniony - powiedział p.o. głównego inspektora farmaceutycznego Zbigniew Niewójt, pytany o przyczyny zamiany leków. Ocenił, że to najbardziej prawdopodobna ewentualność. Poinformował także, że we wtorek spotkał się z polskim przedstawicielem producenta, firmą Sanofi-Aventis. Miała ona zadeklarować, że w środę wyda komunikat w sprawie trybu zwrotu, uzyskania rekompensaty lub wymiany leków.
Wiceminister zdrowia Marek Tombarkiewicz wyjaśnił, że Neurol ma działanie nasenne i uspokajające. Dodał, że chodzi o najmniejszą dawkę leku, więc u osoby dorosłej, w pełni wydolnej zażycie pojedynczej dawki może nie stanowić żadnego zagrożenia, a pacjent może być tylko senny. Jednak w przypadku osób w podeszłym wieku, z niewydolnością wielonarządową, w tym niewydolnością nerek, zażycie Neurolu może być niebezpieczne. Wtedy stosowanie przez jakiś czas takich leków może dawać jakieś niepokojące objawy związane z centralnym układem nerwowym - wiedział wiceszef MZ. Tombarkiewicz zaznaczył, że bardziej obawiać się należy skutków niestosowania substancji zawartej w Atramie - carvedilolu - u osób, które powinny ją zażywać. Jak wyjaśnił, jest to dość popularny lek stosowany w nadciśnieniu tętniczym i niewydolności serca.
Na początku wstrzymaliśmy obrót oboma lekami. Nie wiedzieliśmy, jak duże jest niebezpieczeństwo. Musieliśmy poczekać na informację od Czechów. Dowody na to, że rzeczywiście doszło do pomieszania, zostały znalezione tylko w Atramie - powiedział Trzciński. Pacjenci są proszeni o zwrot określonych serii leku do aptek.
GIF nadal prowadzi postępowanie, czy podjąć decyzję o wycofaniu leku Neurol, ale w tym przypadku - jak powiedział Trzciński - nie ma dowodów na pomieszanie substancji.
(MN)